Nguồn tin của báo Thanh Niên cho biết, ngày 3/9, bác sĩ Nguyễn Tri Thức, Giám đốc Bệnh viện Chợ Rẫy, đã có báo cáo Bộ Y tế và các cơ quan liên quan về việc bệnh viện tiếp nhận 6 bệnh nhân (BN) sau khi dùng Pate Minh Chay. Cụ thể là 2 BN ở Khánh Hòa, 2 BN ở Đồng Nai và 2 BN ở Bà Rịa - Vũng Tàu.
Theo bác sĩ Nguyễn Tri Thức, tất cả 6 BN nhập viện đều có triệu chứng: nôn ói, đau thượng vị, khó thở, suy hô hấp, sụp mi, yếu chi nhưng không sốt không rối loạn tri giác. Các BN đều khai báo có ăn Pate Minh Chay của Công ty TNHH Hai thành viên Lối sống mới (Hà Nội) trước đó từ 1- 2 ngày.
Bệnh viện Chợ Rẫy đã tổ chức hội chẩn gồm các bác sĩ đầu ngành về chuyên khoa hồi sức - chống độc của bệnh viện, Bệnh viện Bệnh nhiệt đới, Bệnh viện quân y 175…
Dựa trên dịch tễ, hội đồng chuyên gia chẩn đoán các bệnh nhân bị ngộ độc vi khuẩn Botulinum. Bệnh viện Chợ Rẫy tiến hành cấy mẫu Pate Minh Chay còn lại còn lại của bệnh nhân và kết quả dương tính với vi khuẩn Clostridium botulinum.
Tuy nhiên, Bệnh viện Chợ Rẫy cho biết hiện nay thuốc antitoxin trị độc tố vi khuẩn Clostridium botulinum không có trên thị trường trong nước. Do thuốc chỉ có tác dụng hiệu quả với bệnh nhân ngộ độc trong vòng 1 tuần nên phải nhập thuốc trước để dự phòng trường hợp xuất hiện thêm các bệnh nhân ngộ độc vì ăn Pate Minh Chay.
Đến nay, Việt Nam có hơn 20 người đến khám hoặc phải nhập viện điều trị do có dấu hiệu nhiễm vi khuẩn Clostridium botulinum được tìm thấy trong pate Minh Chay.
 |
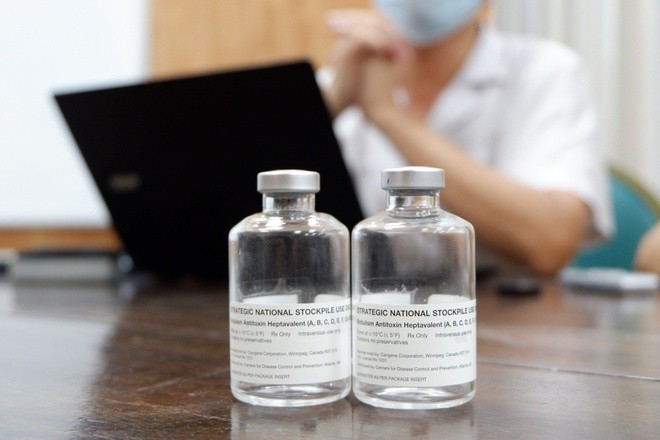
Theo tìm hiểu của Zing.vn, thuốc giải độc cần dùng cho các nạn nhân này có tên đầy đủ là Botulism Antitoxin Heptavalent. Tuy nhiên, Việt Nam chưa có loại này. Trong số bệnh nhân nhiễm vi khuẩn, 2 trường hợp đang điều trị ở Bệnh viện Bạch Mai được sử dụng thuốc giải độc với giá 8.000 USD/lọ, nhập từ Thái Lan. Nguồn kinh phí này được WHO viện trợ.
Hiện nay, Botulism Antitoxin Heptavalent là thuốc giải duy nhất đối với các trường hợp bị nhiễm độc tố botulinum.
Năm 2013, Cục Quản lý Dược phẩm và Thực phẩm Mỹ (FDA) lần đầu tiên phê duyệt loại thuốc này. Công thức thuốc chứa các đoạn immunoglobulin, Fab và F (ab') 2, có hoạt tính trung hòa cùng lúc 7 loại độc tố của vi khuẩn Clostridium botulinum.
FDA cho biết Botulism Antitoxin Heptavalent được làm từ huyết tương ngựa, được cấp phép dựa trên các thử nghiệm trên động vật. Chúng được tạo ra từ kháng thể ngựa phân mảnh nên ít rủi ro hơn các thuốc giải độc khác. Botulism Antitoxin Heptavalent giúp bệnh nhân giảm nguy cơ mắc tác dụng phụ nghiêm trọng.
Chế phẩm sinh học này chưa thử nghiệm lâm sàng trên người vì không khả thi và vi phạm đạo đức ngành y. Trước đó, năm 2007, kho kháng sinh quốc gia của Mỹ bổ sung Botulism Antitoxin Heptavalent để sử dụng trong trường hợp khẩn cấp.
Theo Reuters, Botulism Antitoxin Heptavalent do công ty Winnipeg thuộc Cangene Corp, có trụ sở tại Canada, sản xuất. Dự án phát triển thuốc được Bộ Y tế và Dịch vụ Nhân sinh Mỹ tài trợ 427 triệu USD. Giá thành của thuốc không được công khai chi tiết.
Ngoài thuốc giải độc botulinum cho người lớn, FDA cấp phép thuốc BabyBIG® để điều trị cho trẻ sơ sinh. Giá thành hiện tại của sản phẩm này là 45.300 USD/lọ.